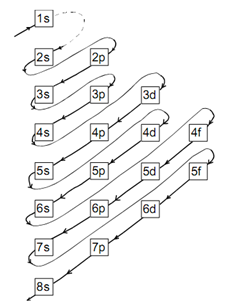
Dalam penulisan konfigurasi elektron dan diagram orbital perlu berlandaskan pada tiga prinsip utama yaitu prinsip aufbau, hukum Hund dan hukum penuh setengah penuh.
A. Azas Aufbau
Azas Aufbau menyatakan bahwa :“Pengisian elektron dimulai dari subkulit yang berenergi paling rendah dilanjutkan pada subkulit yang ludang kecepeh tinggi energinya”. Dalam setiap sub kulit memiliki batasan elektron yang sanggup diisikan yakni :
Subkulit s terbaik diberisi 2 elektron
Subkulit p terbaik diberisi 6 elektron
Subkulit d terbaik diberisi 10 elektron
Subkulit f terbaik diberisi 14 elektron
Berdasarkan ketentuan tersebut maka urutan pengisian (kofigurasi) elektron mengikuti tanda panah pada gambar diberikut!
Berdasarkan diagram di atas sanggup disusun urutan konfigurasi elektron sebagai diberikut :
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 …. dan seterusnya
Keterangan :
Jumlah elektron yang ditulis dalam konfigurasi elektron merupakan jumlah elektron terbaik dari subkulit tersebut kecuali pada bab terakhirnya yang ditulis yakni elektron sisanya. Perhatikan pola di bawah ini :
Jumlah elektron Sc yakni 21 elekron kemudian elektron-elektron tersebut kita isikan dalam konfigurasi elektron menurut prinsip aufbau di atas. Coba kalian perhatikan, ternyata tidak selalu kulit yang ludang kecepeh rendah ditulis terludang kecepeh lampau (4s ditulis lampau dari 3d). Hal ini alasannya semakin besar nomor kulitnya maka selisih energi dengan kulit di atasnya semakin kecil sementara jumlah sub kulitnya semakin banyak sehingga terjadi tumpang tindih urutan energi sub kulitnya. Untuk mempergampang penilisan tingkatenerginya dipakai prinsip aufbau di atas. Untuk keteraturan penulisan, 3d boleh ditulis terludang kecepeh lampau dari 4s namun pengisian elektronnya tetap mengacu pada prinsip aufbau. hal ini terkesan remeh tapi penting..... jadi bila kalian disuruh menuliskan bilangan kuantum dari elektron terakhir dari Sc maka elektron tersebut terletak pada sub kulit 3d bukan 4s, walau dalam penulisan terakhir sendiri yakni sub kulit 4s.....cirinya pada sub kulit 3d tidak terisi penuh elektron sedangkan sub kulit 4s nya terisi penuh.
Penulisan konfigurasi elektron sanggup disingkat dengan penulisan atom dari golongan gas mulia yaitu : He (2 elektron), Ne (10 elektron), Ar (18 elektron), Kr (36 elektron), Xe (54 elektron) dan Rn ( 86 elektron). Hal ini alasannya pada konfigurasi elektron gas mulia setiap sub kulitnya terisi elektron secara penuh.
Konfigurasi elektron dalam atom selain diungkapkan dengan diagram curah hujan, seringkali diungkapkan dalam diagram orbital. Ungkapan yang kedua akan berguna dalam memilih bentuk molekul dan teori hibridisasi.
Yang harus diperhatikan dalam pembuatan diagram orbital :
1. Orbital-orbital dilambangkan dengan kotak
2. Elektron dilambangkan sebagai tanda panah dalam kotak
3. Banyaknya kotak ditentukan menurut bilangan kuantum magnetik, yaitu:
4. Untuk orbital-orbital yang berenergi sama dilambangkan dengan sekelompok kotak yang bersisian, sedangkan orbital dengan tingkat energi berbeda digambarkan dengan kotak yang terpisah.
5. Satu kotak orbital diberisi 2 elektron, satu tanda panah mengarah ke atas dan satu lagi mengarah ke bawah. Pengisan elektron dalam kotak-kotak orbital memakai hukum Hund.
B. Aturan Hund
Friedrich Hund (1927), seorang sangat menguasai fisika dari Jerman mengemukakan hukum pengisian elektron pada orbital yaitu :
“orbital-orbital dengan energi yang sama, masing-masing diisi ludang kecepeh dulu oleh satu elektron arah (spin) yang sama lampau kemudian elektron akan memasuki orbital-orbital secara urut dengan arah (spin) berlawanan atau dengan kata lain dalam subkulit yang sama tiruana orbital masing-masing terisi satu elektron terludang kecepeh dengan arah panah yang sama kemudian sisa elektronnya gres diisikan sebagai elektron pasangannya dengan arah panah sebaliknya”.
Coba perhatikan pola diagram elektron di bawah ini, khususnya pada bab karenanya :
Pada pengisian diagram orbital unsur S pada konfigurasi 3p4, 3 elektron diisikan terludang kecepeh lampau dengan gambar tanda panah ke atas gres sisanya 1 elektron digambar dengan tanda panah ke bawah.
C. Aturan Penuh Setengah Penuh
Sifat ini bekerjasama bersahabat dengan hibridisasi elektron. Aturan ini menyatakan bahwa : “suatu elektron memiliki kecenderungan untuk berpindah orbital apabila sanggup membentuk susunan elektron yang ludang kecepeh stabil.....untuk konfigurasi elektron yang berakhiran pada sub kulit d berlaku hukum penuh setengah penuh. Untuk ludang kecepeh memahamkan teori ini perhatikan juga pola di bawah ini :
24Cr = 1s2 2s2 2p6 3s2 3p6 4s2 3d4 menjadi 24Cr = 1s2 2s2 2p6 3s2 3p6 4s1 3d5
dari pola terlihat apabila 4s diisi 2 elektron maka 3d kurang satu elektron untuk menjadi setengah penuh....maka elektron dari 4s akan berpindah ke 3d. hal ini juga berlaku untuk perkara :
29Cu = 1s2 2s2 2p6 3s2 3p6 4s2 3d9 menjadi 29Cu = 1s2 2s2 2p6 3s2 3p6 4s1 3d10
Penentuan Periode dan Golongan Suatu Unsur
Untuk memilih letak periode suatu unsur relatif gampang. Periode suatu unsur sama dengan nomor kulit terbesarnya dalam konfigurasi elektron. musalnya :
24Cr = 1s2 2s2 2p6 3s2 3p6 4s1 3d5
Nomor kulit terbesarnya yakni 4 (dalam 4s1) maka Cr terletak dalam periode 4
Sedangkan untuk memilih golongan memakai tabel. Bila subkulit terakhirnya pada s atau p maka digolongkan dalam golongan A (utama) sedangkan bila subkulit terakhirnya pada d maka digolongkan dalam golongan B (transisi). Ludang kecepeh tidak ada yang kurangnya coba perhatikan tabel di bawah ini :
Sebagai pola :
24Cr = 1s2 2s2 2p6 3s2 3p6 4s1 3d5
Periode = 4
Golongan = VI B
Advertisement